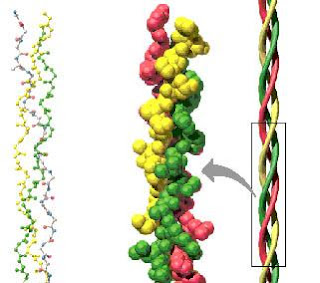
Estructura del ADN
El ADN es una macromolécula que dirige la síntesis de las proteínas específicas para el funcionamiento de cada tipo de célula. El ADN se sintetiza en el núcleo celular y es un ácido nucleico. Cada macromolécula está formada por una sucesión de cientos y miles de moléculas más pequeñas, los nucleótidos. A su vez, cada nucleótido está constituido por la unión de:
- Una pentosa, azúcar de cinco átomos de carbono: la desoxirribosa;
- Una base nitrogenada: puede ser adenina (A), guanina (G), citosina (C) o timina (T), y
- Un grupo fosfato: compuesto por fósforo y oxígeno.
El estudio de la estructura del ADN permitió elaborar un modelo molecular de ADN de doble hélice. Veamos sus características.
Cada molécula de ADN está constituida por dos largas cadenas, enrolladas en espiral alrededor de un eje imaginario, formado una doble hélice. Las pentosas y los grupos fosfato forman el esqueleto externo de la hélice, y las bases nitrogenadas se disponen hacia el interior.
Las dos cadenas son antiparalelas, lo que significa que se disponen en forma paralela pero siguen sentidos opuestos.
Las cadenas se mantienen unidas mediante enlaces que se establecen entre las bases nitrogenadas de ambas. Además, son complementarias, lo que significa que se unen de a pares: la adenina siempre queda enfrentada con la timina, y la guanina, con la citosina. De esta manera, la secuencia de bases nitrogenadas de una de las cadenas determina la secuencia de la otra.
Esta última característica es muy importante. ¿Por qué ?Porque la secuencia de los nucleótidos en cada hebra es la que va a determinar el orden de los aminoácidos en una proteína, es decir, codifica la información genética para sintetizarla.
Ahora bien, solo existen cuatro nucleótidos distintos en la molécula de ADN que se distinguen por sus bases nitrogenadas y es aquí donde está la clave. Al ordenarse en sucesión, pueden hacerlo de muchísimas maneras; el número de variaciones es impresionante y sin duda es el responsable de la variedad de seres vivos. Es el orden específico de los nucleótidos del ADN el que determina el código genético de cada organismo.
Ácidos nucleicos
Los ácidos nucleicos son moléculas complejas, mayores que las de casi todas las proteínas; poseen carbono, oxígeno, hidrógeno, nitrógeno y fósforo. Fueron aislados por Miescher en 1870 en los núcleos de células del pus y deben su nombre al hecho de ser ácidos y de haberse encontrado por primera vez en los núcleos. Hay dos variedades de ácido nucleico: uno que contiene ribosa se llama ácido ribonucleico o ARN y otro conteniendo desoxirribosa, llamado ácido desoxirribonucleico o ADN. Hay distintos tipos de ARN como de ADN, los mismos difieren por sus detalles estructurales y funciones metabólicas. El ADN se encuentra en los cromosomas del núcleo de la célula y, en cantidad mucho menor, en mitocondrias y cloroplastos. Es el principal depósito de información biológica. En células eucarióticas el ARN se encuentra en el núcleo, especialmente en el nucléolo, en los ribosomas y en menor cantidad en otras partes de la célula.
Los ácidos nucleicos están formados por subunidades llamadas nucleótidos, cada uno con una base nitrogenada, un azúcar de cinco carbonos y ácido fosfórico. En ellos hay dos tipos de base nitrogenadas, las purinas y pirimidinas.
El ARN contiene las purinas adenina y guanina, las pirimidinas citosina y uracilo, junto con la pentosa, ribosa y ácido fosfórico. El ADN contiene adenina y guanina, citosina y la pirimidina timina, así como desoxirribosa y ácido fosfórico. Las moléculas de ácidos nucleicos constan de cadenas lineales de nucleótidos, unidas entre sí por enlaces que van del azúcar de una cadena al ácido fosfórico de la otra. La especificidad del ácido nucleico reside en el orden específico de los cuatro tipos de nucleótidos en la cadena; por ejemplo: CCGATTA puede representar un fragmento de una molécula de ADN donde C= citosina, G= guanina, A= adenina y T= timina.
En la actualidad hay pruebas abundantes de que el ADN representa la especificidad y propiedad químicas de los genes, unidades de la herencia. Se conocen varios tipos de ARN, cada uno de los cuales desempeña un papel específico en la síntesis de proteínas específicas por la célula.
Nucleótidos y nucleósidos
Los ácidos nucleicos son polímeros cuyas piezas elementales se llaman nucleótidos, y se unen entre sí con una disposición determinada. Los nucleótidos están constituidos por tres elementos:
bases pirimidínicas, derivadas de la pirimidina: citosina, timina y uracilo
Alteraciones de la información genética: mutaciones
Las mutaciones pueden ocurrir durante la replicación del ADN cuando, por error, un nucleótido se cambia por otro, o se agregan o se pierden nucleótidos de la secuencia.
Ácidos nucleicos
Los ácidos nucleicos son moléculas complejas, mayores que las de casi todas las proteínas; poseen carbono, oxígeno, hidrógeno, nitrógeno y fósforo. Fueron aislados por Miescher en 1870 en los núcleos de células del pus y deben su nombre al hecho de ser ácidos y de haberse encontrado por primera vez en los núcleos. Hay dos variedades de ácido nucleico: uno que contiene ribosa se llama ácido ribonucleico o ARN y otro conteniendo desoxirribosa, llamado ácido desoxirribonucleico o ADN. Hay distintos tipos de ARN como de ADN, los mismos difieren por sus detalles estructurales y funciones metabólicas. El ADN se encuentra en los cromosomas del núcleo de la célula y, en cantidad mucho menor, en mitocondrias y cloroplastos. Es el principal depósito de información biológica. En células eucarióticas el ARN se encuentra en el núcleo, especialmente en el nucléolo, en los ribosomas y en menor cantidad en otras partes de la célula.
Los ácidos nucleicos están formados por subunidades llamadas nucleótidos, cada uno con una base nitrogenada, un azúcar de cinco carbonos y ácido fosfórico. En ellos hay dos tipos de base nitrogenadas, las purinas y pirimidinas.
El ARN contiene las purinas adenina y guanina, las pirimidinas citosina y uracilo, junto con la pentosa, ribosa y ácido fosfórico. El ADN contiene adenina y guanina, citosina y la pirimidina timina, así como desoxirribosa y ácido fosfórico. Las moléculas de ácidos nucleicos constan de cadenas lineales de nucleótidos, unidas entre sí por enlaces que van del azúcar de una cadena al ácido fosfórico de la otra. La especificidad del ácido nucleico reside en el orden específico de los cuatro tipos de nucleótidos en la cadena; por ejemplo: CCGATTA puede representar un fragmento de una molécula de ADN donde C= citosina, G= guanina, A= adenina y T= timina.
En la actualidad hay pruebas abundantes de que el ADN representa la especificidad y propiedad químicas de los genes, unidades de la herencia. Se conocen varios tipos de ARN, cada uno de los cuales desempeña un papel específico en la síntesis de proteínas específicas por la célula.
Nucleótidos y nucleósidos
Los ácidos nucleicos son polímeros cuyas piezas elementales se llaman nucleótidos, y se unen entre sí con una disposición determinada. Los nucleótidos están constituidos por tres elementos:
- bases nitrogenadas: compuestos que incluyen nitrógeno en su molécula, y tienen un carácter básico. Las hay de dos tipos:
bases pirimidínicas, derivadas de la pirimidina: citosina, timina y uracilo
- pentosas: monosacáridos del tipo de las pentosas (5 átomos de carbono), que en los nucléotidos pueden ser ribosa y desoxirribosa.
Los nucleósidos son compuestos formados por una pentosa más una base nitrogenada. Se nombran con el nombre de la base nitrogenada más el sufijo "osina" o "idina" (para bases púricas o pirimidínicas, respectivamente); si además la pentosa es la desoxirribosa, se añade el prefijo "desoxi" (ej.: guanosina, adenosina, uridina, desoxitimidina, etc.)
- ácido fosfórico
La unión de un nucleósido y moléculas de ácido fosfórico dan lugar a la formación de nucleótidos, que pueden tener una, dos o tres de estas moléculas:
Funciones de ácidos nucleicos
El ADN es el portador del mensaje genético que pasará de una célula a sus células hijas, pero para ello primero ha de duplicarse mediante un proceso conocido como replicación. Luego, el código genético contenido en el ADN dará lugar a la síntesis de proteínas, mediante dos procesos diferentes:
- transcripción: mediante el cual un fragmento de ADN es copiado en una molécula de ARN, que contendrá exactamente el mismo código que la molécula de ADN de la que procede.
- traducción: se sintetiza la proteína correspondiente al código de ADN; y para ello han de intervenir los tres tipos de ARN.
La replicación del ADN
Sabemos que una célula se origina a partir de otra célula. Entonces, ¿de qué manera las células hijas heredan la información genética?
Para que una célula pueda dividirse, es necesario que previamente duplique su material genético. ¿Te das cuenta? La finalidad de la autoduplicación o replicación del ADN es mantener constante la información que se traspasa a cada célula hija, y producir una copia idéntica para cada una.
En las células que se dividen por mitosis (células somáticas), la replicación permite que las células hijas reciban una copia del ADN de la célula que les dio origen y, por lo tanto, que tengan las mismas características. En las células que se dividen por meiosis (células sexuales: óvulos y espermatozoides), la duplicación, seguida por dos divisores celulares consecutivas, permite que la mitad del ADN llegue a los gametos. Así cuando los gametos se unen en la fecundación, las características se transmiten a la descendencia.
Para que la replicación ocurra, la célula necesita las moléculas que constituyen los diferentes nucleótidos y una serie de enzimas que controlan el proceso en todo momento. Así es como se realiza:
1.- La replicación comienza con la rotura de los enlaces que unen las bases nitrogenadas complementarias de ambas cadenas. De esta forma, las dos hebras comienzan a desenrollarse. En este proceso intervienen enzimas que permiten la separación.
2.- Cada cadena va a servir de molde para la síntesis de una nueva cadena complementaria. Cuando ambas se separan, enzimas específicas van leyendo la información y uniendo los nucleótidos complementarios.
3.- De esta manera quedan formadas dos nuevas cadenas dobles. Ahora, cada una de las nuevas cadenas de doble hélice contiene una de las hebras del ADN de origen y otra nueva, por eso se dice que la replicación es semiconservativa.
El tiempo que tarda el ADN en replicarse es de alrededor de siete horas. En realidad, semejante proceso tendría que durar mucho más si la duplicación se realizara de una punta a la otra de cada cromosoma. Sin embargo, esto no ocurre. La célula utiliza “estrategias” mediante las cuales el material genético se duplica en períodos más cortos. La replicación del ADN ocurre en varios puntos a la vez, en distintos tramos de la molécula.
A.- Las enzimas separan las dos hebras de la cadena helicoidal de ADN en puntos específicos. Las enzimas ADN helicasa desenrollan cada hebra de ADN.
B.- La enzima ADN polimerasa lee cada hebra y fabrica una nueva uniendo los nucleótidos complementarios. La lectura de la cadena molde avanza hacia un lado en una hebra y hacia el otro, en la otra.
C.- Finalmente, se obtienen dos cadenas nuevas de ADN, una por cada hebra del ADN original.
Sabemos que el ADN es un banco de información que se conserva y se transmite de generación en generación. Ahora bien, en cada célula esa información es leída e interpretada para la fabricación o síntesis de proteínas específicas. Por eso decimos que las proteínas son productos de la expresión del ADN.
¿Cómo es entonces que se sintetizan las proteínas? ¿Cómo se unen los aminoácidos en el orden y número específico para cada proteína?
Cuando los científicos comenzaron la búsqueda del mecanismo que permitiera la expresión del ADN, descubrieron otra biomolécula muy parecida, el ARN (ácido ribonucleico). Este ARN se fabrica en el núcleo y, como veremos, es una copia de una pequeña parte del ADN.
El proceso de síntesis de proteínas es similar en todas las células y puede resumirse en dos fases:
Transcripción: consiste en copiar la información genética contenida en el ADN a una molécula de ARNm (mensajero). (1) La doble hélice de ADN se abre y una de sus cadenas constituye el molde para sintetizar una molécula de ARNm. (2) Los nucleótidos libres de ARN que están en el núcleo se aparean con las bases expuestas del ADN siguiendo las reglas de complementariedad de bases: la base complementaria de la adenina (A) es el uracilo (U), en lugar de la timina (T), y se forma una molécula de ARNm. (3) El ARNm sale hacia el citoplasma y se dirige a los ribosomas.
Traducción: consiste en traducir el mensaje del ARNm al lenguaje de las proteínas. Es como copiar primero un texto en el núcleo y luego traducirlo a otro idioma en el citoplasma. ¿Y el traductor? Se trata de otra molécula de ARN llamada “de transferencia”, el ARNt, capaz de “leer” la información en forma de tripletes de bases del ARNm (es decir, cada tres bases) y de identificar el aminoácido al que equivale. Su capacidad de traducir se debe a la estructura de la molécula: uno de sus extremos reconoce y se une a un solo tipo de aminoácido y el otro está formado por tres bases complementarias con el ARNm. (4) Los ARNt “cargan” los aminoácidos y los transportan hasta el lugar correspondiente en el ARNm que está pegado al ribosoma. (5) Las tres bases del ARNt se acoplan con el triplete del ARNm que corresponde al aminoácido transportado y lo ubica en esa posición. El siguiente aminoácido encaja de la misma manera y se une al anterior. (6) Los aminoácidos se van ubicando uno a uno. (7) Los ARNt se separan de su aminoácido y quedan libres en el citoplasma. El proceso continúa hasta que hayan sido ensamblados todos los aminoácidos que forman la proteína.
Los genes y el genoma
Un gen es un fragmento del ADN, una ¨unidad funcional de información¨ que contiene el material genético proveniente de nuestros antecesores.
El conjunto de todos los genes y la secuencia de nucleótidos que forman los cromosomas de una célula constituyen el genoma. En los organismos procariontes, el genoma está formado por un solo cromosoma circular. Algunas bacterias, además, poseen plásmidos, que son moléculas de ADN circulares que se replican en forma independiente del cromosoma bacteriano.
Un gen es un fragmento del ADN, una ¨unidad funcional de información¨ que contiene el material genético proveniente de nuestros antecesores.
El conjunto de todos los genes y la secuencia de nucleótidos que forman los cromosomas de una célula constituyen el genoma. En los organismos procariontes, el genoma está formado por un solo cromosoma circular. Algunas bacterias, además, poseen plásmidos, que son moléculas de ADN circulares que se replican en forma independiente del cromosoma bacteriano.
Hay aproximadamente 30.000 genes en cada célula del cuerpo humano
En los organismos eucariontes, la mayor parte del genoma constituye la cromatina, localizada en el núcleo de la célula. Pero ¿sabías que otra parte del ADN se encuentra en los cloroplastos y en las mitocondrias?
En el genoma nuclear, alrededor del 30% son genes que se encuentran separados por regiones intergéneticas en las que el ADN no tiene una función conocida. Se calcula que solo el 5% de nuestro genoma tiene información para codificar proteínas.
El ADN que está en la matriz de las mitocondrias constituye el genoma mitocondrial. Representa el 1% del genoma total y no presenta regiones inactivas, como tiene el genoma nuclear. Se transmite solo por vía materna, ya que, en la gestación, es el óvulo el que aporta las mitocondrias al cigoto.
El ADN mitocondrial se utiliza en la actualidad para obtener pruebas de identidad de la vía hereditaria materna. Por ejemplo para averiguar el parentesco con personas fallecidas, en caso de no contar con ADN nuclear.
El código genético universal
El código genético es el lenguaje de los genes. Las bases nitrogenadas que forman las moléculas de ADN y ARN son como letras con las cuales se escriben instrucciones para que las células sinteticen proteínas.
Cada uno de los tripletes del ARNm se llama codón y, como vimos, se ¨traducen¨ al lenguaje de las proteínas siguiendo un código. Cada molécula de ARNt porta en uno de sus extremos un aminoácido concreto; además, tiene un triplete de nucleótidos, llamado anticodón, complementario de un codón determinado del ARNm. De esta manera, si el codón del ARNm es UGG, el anticodón complementario del ARNt será ACC, y el aminoácido que portará el triptófano (Trp). Así, los ARNt van añadiendo aminoácidos a la cadena polipeptídica en formación, según el orden de los codones del ARNm.
El código genético es universal, esto significa que es el mismo para todos los seres vivos. Así, por ejemplo, el codón GCC codifica para el aminoácido alanina en cualquier organismo.
Tenemos que aclarar que se han descubierto unas pocas excepciones a esta universalidad; al ser mínimas, se sostiene un origen único para todos los seres vivos.Alteraciones de la información genética: mutaciones
Cuando se expresa un gen, se forma una clase de proteína con alguna estructura y función particular.
 |
| Un ejemplo de mutación genética : el leucistisme del león blanco |
Quizá la modificación de un nucleótido por otro no parecería ser tan problemática. En definitiva, es una pequeña parte del ADN. lo cierto es que, a veces, estos cambios pasan inadvertidos, dado que no todos los nucleótidos de la inmensa cantidad que contiene el ADN forman parte de un gen y, por lo tanto, sus alteraciones no traen consecuencias. Por otro lado, a veces los cambios de un nucleótido suelen terminar en el mismo aminoácido, ya que varios tripletes codifican para el mismo aminoácido. A estas mutaciones se las llama silenciosas.
También existen enzimas de reparación que se encargan de detectar los nucleótidos incorrectamente apareados, los retiran y los reemplazan por los correctos. De esta manera, la cantidad de mutaciones es muy baja.